
10/12/2024 09:30
Tìm hiểu tính chất hóa học của kim loại trong ngành công nghiệp
Tính chất hóa học của kim loại: Tầm quan trọng và ứng dụng
Kim loại, với vai trò chủ chốt trong nhiều lĩnh vực của đời sống, không chỉ là vật liệu được sử dụng trong xây dựng mà còn là yếu tố quyết định trong ngành công nghiệp hóa chất, điện tử, và nhiều ngành khác. Bài viết này sẽ cung cấp cái nhìn toàn diện về tính chất hóa học của kim loại, bao gồm các phản ứng với nước, dung dịch muối, axit, và oxit, cũng như dãy điện hóa kim loại.


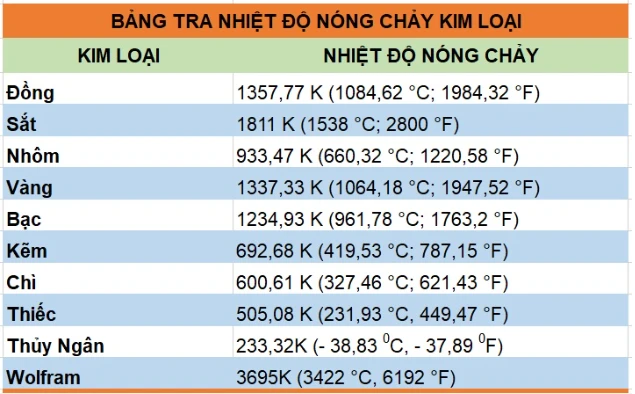

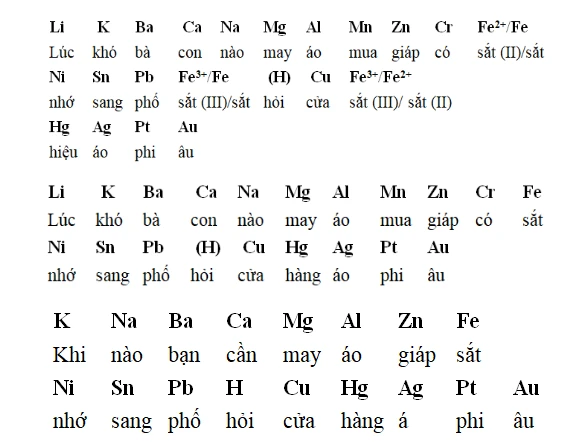

1. Tính chất hóa học của kim loại

1.1 Tác dụng với nước
a. Ở nhiệt độ thường
Kim loại kiềm và kiềm thổ có khả năng phản ứng với nước để tạo ra hydroxide và khí hydro. Một phản ứng điển hình có thể được biểu diễn như sau: \[ 2M + 2nH_2O \rightarrow 2M(OH)_n + nH_2 \] Trong đó, M là kim loại kiềm hoặc kiềm thổ.b. Ở nhiệt độ cao
Ở nhiệt độ cao, phản ứng của kim loại với nước trở nên phức tạp. Chẳng hạn như nhôm và magie, tại nhiệt độ cao, chúng có thể tạo thành oxit kim loại thay vì hydroxide. Dưới đây là một số phản ứng tiêu biểu:- Mg + 2H2O \rightarrow Mg(OH)2 + H2 (ở 100 °C)
- Mg + 2H2O \rightarrow MgO + H2 (khi nhiệt độ ≥ 200 °C)
- 3Fe + 4H2O → Fe3O4 + 4H2 (ở nhiệt độ < 570 °C)

1.2 Tác dụng với dung dịch muối
Kim loại mạnh có khả năng đẩy các kim loại yếu hơn ra khỏi dung dịch muối. Ví dụ:- Fe + CuSO4 \rightarrow FeSO4 + Cu

1.3 Tác dụng với dung dịch kiềm
Nhiều kim loại như natri (Na), canxi (Ca), và kali (K) phản ứng với nước trong dung dịch kiềm để tạo ra muối và khí hydro. Hơn nữa, một số kim loại còn có tính chất lưỡng tính sẽ phản ứng với dung dịch kiềm và sinh ra muối mới. \[ 2Al + 2NaOH + 2H2O \rightarrow 2NaAlO2 + 3H2 \]
1.4 Tác dụng với dung dịch axit
Kim loại sẽ phản ứng với axit, như H2SO4 hoặc HCl, để tạo ra muối và sản phẩm khử. Lưu ý rằng không phải tất cả kim loại đều phản ứng với các axit này. Vàng (Au) và bạch kim (Pt) là hai kim loại không phản ứng với H2SO4 đặc và HNO3. Một số phản ứng điển hình gồm:- Cu + 2H2SO4 (loãng) \rightarrow CuSO4 + H2
1.5 Tác dụng với phi kim
Các kim loại có khả năng phản ứng với phi kim như lưu huỳnh, clo và oxi. Chẳng hạn:- Fe + S \rightarrow FeS
- 2Fe + 3Cl2 \rightarrow 2FeCl3
2. Dãy điện hóa kim loại
2.1 Khái niệm dãy điện hóa
Dãy điện hóa kim loại được xây dựng dựa trên khả năng nhường và nhận electron của các ion kim loại. Nó thể hiện tính oxi hóa và khử của các kim loại. Cặp kim loại sẽ được sắp xếp từ kim loại dễ khử đến kim loại khó khử.2.2 Ý nghĩa của dãy điện hóa
- Giúp đánh giá tính oxi hóa và khử của kim loại.
- Dự đoán chiều của phản ứng oxi hóa - khử giữa các cặp kim loại.
2.3 Ghi nhớ dãy điện hóa kim loại
Để nhớ dãy điện hóa này, có thể áp dụng các mẹo gợi nhớ, chẳng hạn như sử dụng hình ảnh minh họa hoặc liên kết các kim loại với tính chất đặc trưng của chúng.3. Ứng dụng của tính chất hóa học của kim loại
3.1 Ứng dụng trong công nghiệp
Tính chất hóa học của kim loại đã giúp con người phát triển nhiều công nghiệp khác nhau, từ sản xuất thép, điện cực trong hóa học, đến ngành chế tạo điện tử, vi mạch.3.2 An toàn và môi trường
Việc hiểu rõ tính chất hóa học của kim loại còn hỗ trợ trong việc quản lý chất thải và an toàn lao động trong công nghiệp, tránh những rủi ro không đáng có trong quá trình sản xuất.4. Kết luận
Tính chất hóa học của kim loại không chỉ ảnh hưởng đến ngành công nghiệp mà còn định hình nhiều khía cạnh trong đời sống hàng ngày. Hiểu biết về những đặc điểm này sẽ giúp cho việc ứng dụng và phát triển công nghệ mới, tối ưu hóa quy trình sản xuất và đảm bảo an toàn lao động. Bài viết trên đã giúp bạn có cái nhìn sâu sắc về các tính chất hóa học của kim loại. Hãy theo dõi để khám phá thêm nhiều kiến thức thú vị và bổ ích trong lĩnh vực hóa học này!
Link nội dung: https://bitly.vn/tim-hieu-tinh-chat-hoa-hoc-cua-kim-loai-trong-nganh-cong-nghiep-a15538.html