
15/12/2024 14:55
Nguyên tố số 51 trong bảng tuần hoàn hóa học
Nguyên tố số 51 trong bảng tuần hoàn hóa học chính là Antimon (Sb). Trong bài viết này, chúng ta sẽ cùng khám phá những đặc điểm, tính chất và ứng dụng của nguyên tố này. Hãy cùng Admin tìm hiểu về Antimon ngay bây giờ!




Bảng tuần hoàn hóa học là gì?
Bảng tuần hoàn hóa học là bảng sắp xếp các nguyên tố theo thứ tự tăng dần của số hiệu nguyên tử. Nó không chỉ giúp tổ chức và phân loại các nguyên tố mà còn cung cấp thông tin về tính chất hóa học của chúng. Bảng tuần hoàn được phát triển bởi nhà khoa học Mendeleev và Moseley vào giữa thế kỷ 19 đến đầu 20.
Cách tổ chức bảng tuần hoàn
Các nguyên tố trong bảng tuần hoàn được tổ chức theo các quy tắc sau:- Cách sắp xếp: Các nguyên tố được sắp theo thứ tự tăng dần của điện tích hạt nhân nguyên tử.
- Cùng một hàng: Các nguyên tố nằm cùng một hàng sẽ có cùng số lớp electron trong nguyên tử.
- Cùng một cột: Những nguyên tố có số electron hóa trị trong nguyên tử giống nhau sẽ được xếp vào cùng một cột.

Nguyên tố 51 trong Bảng tuần hoàn
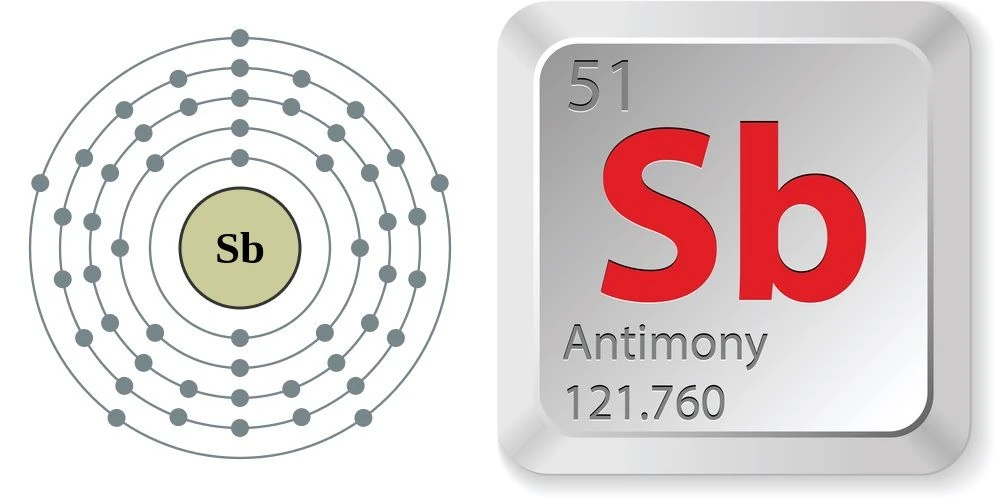
Nguyên tố 51, hay còn gọi là Antimon, có những thông tin cơ bản như sau:- Ký hiệu hóa học: Sb
- Nguyên tử khối: 121,75 g/mol
- Số đơn vị điện tích hạt nhân: Z = 51
- Độ âm điện: 2,05
- Cấu hình electron: [Kr] 4d10 5s2 5p3
- Vị trí: Ô số 51 | Chu kỳ 5 | Nhóm VA
- Số electron lớp ngoài cùng: 5

Đặc tính của Nguyên tố 51
Antimon (Sb) có nhiều đặc tính vật lý và hóa học đáng chú ý.Đặc tính vật lý
- Trạng thái: Antimon tồn tại ở dạng rắn trong điều kiện tiêu chuẩn, với các dạng đặc thù như không kim loại và kim loại.
- Màu sắc: Màu bạc trắng.
- Điểm nóng chảy: 630.63 K (357.48 °C).
- Điểm sôi: 1750 K (1477 °C).
- Khối lượng riêng: 6.697 g/cm³.
- Độ cứng: 3 (theo thang độ cứng Mohs).
- Điện tích ion hóa: 8.608 eV.
Đặc tính hóa học
- Số oxi hóa phổ biến: -3, +3, +5.
- Reakció: Antimon có khả năng tác dụng với axit nitric và hydrocloric nóng.
- Hợp chất: Có thể tạo thành hợp chất halogenua với halogen.
- Chất khử mạnh: Sử dụng trong nhiều ứng dụng công nghiệp và có mặt trong các hợp kim.
Ứng dụng của Nguyên tố 51 trong đời sống
Antimon có nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau:- Hợp kim: Antimon được sử dụng để sản xuất hợp kim chì-antimon và hợp kim bismut-antimon, có tính chống ăn mòn tốt.
- Chất khử: Vì có tính khử mạnh, antimon được dùng trong sản xuất chất khử cho các kim loại khác.
- Chất chống cháy: Sản xuất các chất chống cháy trong ngành công nghiệp polyvinyl chloride (PVC).
- Dược phẩm: Antimon được sử dụng trong việc sản xuất thuốc chữa bệnh truyền nhiễm.
- Điện tử: Dùng trong sản xuất các linh kiện điện tử, diode và transistor.
- Trang sức: Antimon có màu trắng bạc và được ứng dụng sản xuất đồ trang sức.
- Sản xuất pin: Tăng cường hiệu suất trong các loại pin.
- Ngành y tế: Chống khuẩn và điều trị bệnh ngoài da.
- Sản xuất thủy tinh: Tăng cường độ cứng và độ bền cho thủy tinh.
- Mực in: Sản xuất mực in với độ bền cao.
- Sản phẩm gốm sứ: Cải thiện tính chất chống cháy và độ bền cho sản phẩm.
Phương pháp điều chế Antimon
Antimon (Sb) có thể được sản xuất bằng nhiều phương pháp khác nhau:- Đốt khí antimonit trong không khí:
- Khử oxit của antimonit bằng cacbon:
- Phản ứng với axit clohidric:
Kết luận
Nguyên tố số 51 trong bảng tuần hoàn hóa học là antimon, một nguyên tố quan trọng trong nhiều lĩnh vực từ công nghiệp đến y tế. Nhờ vào những đặc tính vật lý và hóa học đặc biệt, antimon đã được ứng dụng rộng rãi trong sản xuất và đời sống hàng ngày. Hy vọng rằng bài viết này sẽ hữu ích cho những ai đam mê tìm hiểu về hóa học và nguyên tố Antimon. Nếu bạn có thắc mắc hay cần thêm thông tin, đừng ngần ngại để lại câu hỏi nhé! Chúc các bạn học tốt và đạt kết quả cao trong môn Hóa học!
Link nội dung: https://bitly.vn/nguyen-to-so-51-trong-bang-tuan-hoan-hoa-hoc-a15884.html