
CO3 hóa trị mấy? Tổng hợp tất cả những thông tin cần biết về CO3
Trong bài học hóa trị các em thường xuyên thấy gốc CO3 xuất hiện với các công thức CaCO3,Na2CO3,H2CO3…Vậy CO3 là gốc gì? CO3 hóa trị mấy? Nhóm kèm CO3 hóa trị bao nhiêu? Bài viết sau đây của Admin sẽ giải đáp giúp các em nắm rõ chi tiết nhất về CO3 về tính chất, công dụng, cách điều chế nhé!
CO3 là gốc gì?
Thực tế CO3 là một gốc thuộc Acid carbonic, tên gọi khác của gốc là ca-bừn-nết khi đọc tên các hợp chất muối có gốc CO3. Và khi CO3 không nằm trong bất kỳ hợp chất muối nào sẽ đọc là Carbon trioxide.
Trong đó, Acid carbonic đây là một acid yếu với công thức hóa học là H2CO3. Acid carbonic sẽ tạo ra hai muối: thứ nhất là Carbonate, thứ hai là muối Bicarbonate.
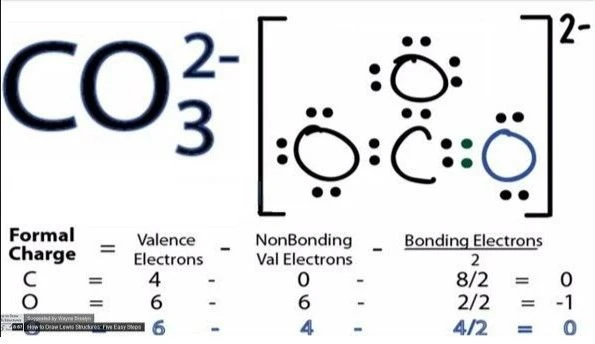
CO3 là gốc gì?
CO3 hóa trị mấy?
Cấu trúc của Carbonate tuân theo quy tắc octet vậy nên dựa theo cấu trúc này cả oxygen cũng mang dấu âm. Và hóa trị định nghĩa là số lượng liên kết hình thành bởi nguyên tử từ đó dẫn đến hình thành hợp chất.
Carbonate có thể kết hợp với hai nguyên tử Hydrogen dựa theo công thức hóa học của acid carbonic H2CO3 thì có thể quy đổi hóa trị như sau:
H2CO3 có Hydrogen mang hoá trị I và gọi a là hóa trị của CO3 và dựa theo quy tắc.
1.2 = a.1 => a = 2
Vậy có thể kết luận gốc CO3 mang hóa trị là II. Khối lượng mol, khối lượng phân tử CO3 đều là 60,009.
Cách điều chế CO3
Bình thường việc điều chế CO3 khá đơn giản bằng cách thổi một luồng không khí vào trong nước sạch. Chỉ là với phương thức này sẽ có nhận thấy được sự khác biệt.
PTPƯ thể hiện cho quá trình điều chế trên:
CO2+H2O→H2CO3
Các loại hợp chất thường thấy của CO3
Các loại hợp chất thường thấy của CO3
Có hai hợp chất chính của CO3 là với acid carbonic và muối Carbonate. Cụ thể về hai hợp chất như sau:
Hợp chất axit Cacbonic - H2CO3
Tính chất vật lý cùng trạng thái tự nhiên:
- Khí carbon dioxide có hòa tan trong nước tự nhiên và nước mưa. Cứ 1000m3 nước trung bình hòa tan 90m3 CO2.
- Một phần của khí CO2 sẽ tác dụng với nước từ đó tạo thành dung dịch acid carbonic. Khi này phần lớn tồn tại dưới dạng phân tử CO2.
Tính chất hóa học:
- H2CO3 chính là một acid yếu, dung dịch này làm quỳ tím chuyển đỏ nhạt và bị acid mạnh đẩy ra khỏi muối.
- H2CO3 cũng là một acid không bền, dung dịch H2CO3 tạo thành trong các phản ứng hóa học sau đó bị phân hủy thành CO2,H2O.
Hợp chất muối Cacbonat
Muối Carbonate chia làm 2 loại muối là muối Carbonate trung hòa (muối Carbonate) và muối Carbonate acid (muối hidrocarbonate). Về muối Carbonate trung hòa không còn nguyên tố H tồn tại trong thành phần acid - base như: Sodium Carbonate (Na2CO3), Magnesium carbonate, Calcium Carbonate (CaCO3).
Muối Carbonate của acid nghĩa là trong gốc acid vẫn còn chứa nguyên tố H như: Sodium Bicarbonate NaHCO3; Calcium Bicarbonate Ca(HCO3)2, Potassium bicarbonate KHCO3,…
Hợp chất muối Carbonate
Tính tan muối Carbonate:
- Đa số muối Carbonate thường không tan trong nước chỉ trừ các muối của kim loại kiềm như Na2CO3,K2CO3,... sẽ có tan trong nước.
- Các muối hidrocarbonate đều tan trong nước ví dụ như Mg(HCO3)2 và Ca(HCO3)2.
Tính chất hóa học của muối Carbonate:

Tính chất hóa học của muối Carbonate
- Muối Carbonate tác dụng với dung dịch acid mạnh như HCl,H2SO4 và HNO3 để tạo ra muối mới và CO2.
PTHH:
NaHCO3+HCl→NaCl+CO2+H2O
- Một số dung dịch muối Carbonate khác sẽ tác dụng với dung dịch base từ đó tạo ra muối mới và base mới.
PTHH:
K2CO3+Ca(OH)2→2KOH+CaCO3
- Dung dịch muối Carbonate tác dụng với một số dung dịch muối thông qua phản ứng tạo ra hai muối mới.
PTHH:
Na2CO3+CaCl2→2NaCl+CaCO3
- Ngoài ra nhiều muối Carbonate có trừ K2CO3
PTHH:
CaCO3→CaO+CO2
2NaHCO3(r)→Na2CO3(r)+H2O(h)+CO2(k)
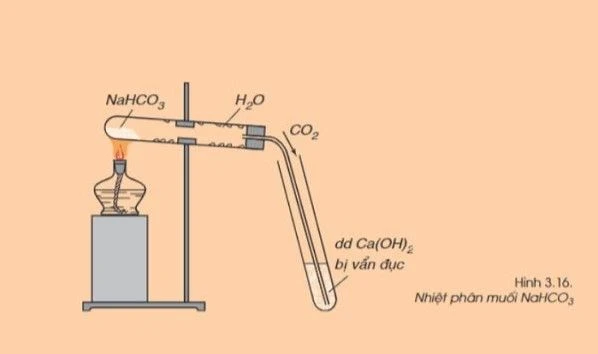
Na2CO3 dễ phân hủy và giải phóng khí CO2
Muối Carbonate hiện nay được ứng dụng khá phổ biến trong đời sống thực tiễn và sản xuất công nghiệp. Mỗi một loại muối Carbonate đều có tính chất ứng dụng riêng.
- Calcium Carbonate (CaCO3) dùng sản xuất xi măng, vôi; ứng dụng trong lĩnh vực công nghiệp xây dựng về đá cẩm thạch, đá xây dựng; ứng dụng cho ngành sơn vai trò là chất độn chính; ứng dụng làm khung nhựa, tấm trần và ống PVC,...
- Muối Sodium Carbonate (Na2CO3) dùng nấu xà phòng, thủy tinh; là nguyên liệu chiếm 13 - 15% trong sản xuất thủy tinh; làm chất phụ gia xà phòng, chất tẩy rửa và làm nguyên liệu hỗ trợ cho hóa chất gốc sodium.
- Muối Sodium hidrocarbonate (NaHCO3) được sử dụng làm dược phẩm; ứng dụng làm hoá chất trong bình cứu hoả; tạo độ giòn, làm đẹp cho bánh, xốp; tăng pH và tạo bọt cho một số loại thuốc nhức đầu; hỗ trợ giải quyết vấn đề răng miệng, ứng dụng chế phẩm trung hòa acid trong chữa bệnh dạ dày,...
Cách nhận biết ion Cacbonat
Để nhận biết ion Carbonate các em cần cho tác dụng với dung dịch acid nếu tạo hiện tượng sủi bọt khí CO2 thì đó là ion Carbonate.
PTHH:
CaCO3+2HCl→CaCl2+CO2+H2O
Một số ứng dụng của muối Cacbonat
CO3 đề cập đến ion Carbonate, có công thức hóa học là CO32-. Ion này có một số ứng dụng quan trọng trong các lĩnh vực khác nhau:

Một số ứng dụng của muối Carbonate
- Calciumi carbonate (CaCO3): Calciumi carbonate được sử dụng làm cẩm thạch và đá xây dựng. Nó cũng là thành phần chính trong quá trình sản xuất xi măng. Calciumi carbonate được sử dụng như một chất độn chính trong sơn và có thể cải thiện tính chất của màng sơn. Calciumi carbonate có thể được sử dụng để tạo thành tấm trần, khung nhựa và ống PVC.
- Sodium carbonate (Na2CO3): Sodium carbonate là một nguyên liệu quan trọng để sản xuất thủy tinh. Sodium carbonate được sử dụng như một chất phụ gia trong sản xuất xà phòng và chất tẩy rửa. Nó cũng là nguyên liệu cho nhiều sản phẩm hóa chất gốc sodium.
- Sodium Bicarbonate (NaHCO3 - baking soda): Sodium Bicarbonate được sử dụng để tạo độ giòn, xốp và làm đẹp cho bánh và các sản phẩm nướng khác. Sodium Bicarbonate được sử dụng để tạo bọt và tăng pH trong một số loại thuốc, như thuốc nhức đầu. Nó cũng có thể giải quyết các vấn đề răng miệng như phòng ngừa sâu răng, mòn răng và bệnh nha chu. Ngoài ra, Sodium Bicarbonate cũng được sử dụng trong các chế phẩm trung hòa acid dịch vị chữa bệnh trào ngược dạ dày.
Những thông tin sơ lược trên bài viết mà Admin tổng hợp mong rằng sẽ có ích cho các em trong khi tìm hiểu về CO3 hóa trị mấy. Hy vọng thông tin sẽ bổ sung thêm kho tàng kiến thức cho bộ môn hóa học của chính các em giúp nâng cao kết quả học tập.
Link nội dung: https://bitly.vn/co3-hoa-tri-may-tong-hop-tat-ca-nhung-thong-tin-can-biet-ve-co3-a16599.html