Giới thiệu
Cân bằng hóa học là một trong những khái niệm quan trọng trong hóa học mà mọi học sinh cần nắm vững. Bài 1 trong sách bài tập hóa học 11 sẽ giúp các em hiểu rõ hơn về phân loại phản ứng thuận nghịch, hằng số cân bằng và ảnh hưởng của các yếu tố như nhiệt độ, áp suất, và nồng độ đến trạng thái này. Trong bài viết này, chúng ta sẽ cùng tìm hiểu chi tiết về nội dung của bài 1 trong sách bài tập hóa học 11, giải thích và làm rõ các câu hỏi, bài tập kèm theo.
Khái niệm phản ứng thuận nghịch
Phản ứng thuận nghịch là gì?
Phản ứng thuận nghịch là sản phẩm có thể phản ứng trở lại thành chất ban đầu. Cụ thể, trong một phản ứng thuận nghịch, ở cùng một điều kiện, có sự chuyển đổi giữa các chất phản ứng và các chất sản phẩm diễn ra đồng thời.
Tính chất của phản ứng thuận nghịch
- Tốc độ phản ứng: Tại trạng thái cân bằng, tốc độ của phản ứng thuận sẽ bằng tốc độ của phản ứng nghịch.
- Cân bằng động: Cân bằng hóa học không có nghĩa là phản ứng ngừng lại, mà cả hai phản ứng vẫn xảy ra nhưng cân bằng lẫn nhau.
Cân bằng hóa học
Cân bằng hóa học xảy ra khi nồng độ của các chất tham gia phản ứng và sản phẩm không thay đổi theo thời gian dù phản ứng vẫn diễn ra. Cường độ của sự chuyển hóa giữa chất phản ứng và sản phẩm là tương đương.
Hằng số cân bằng (Kc)
Hằng số cân bằng (Kc) là một giá trị mô tả mối quan hệ giữa nồng độ của các chất khi hệ đạt trạng thái cân bằng. Hằng số này được xác định bởi:
Kc = [Sản phẩm]^a / [Chất phản ứng]^b
Trong đó:
- [Sản phẩm] và [Chất phản ứng] là nồng độ mol trên lít (M) tại trạng thái cân bằng.
- a và b là hệ số mol trong phương trình phản ứng.
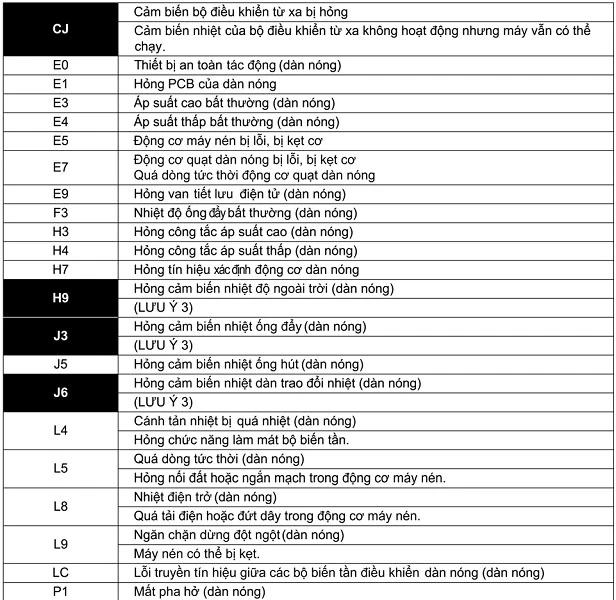
Bài tập SBT Hóa 11 Bài 1
Bài 1.1: Điền từ ngữ thích hợp
- a) Phản ứng thuận nghịch là phản ứng hóa học trong đó ở cùng điều kiện, xảy ra (1) đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển (2) chất sản phẩm thành (3) chất phản ứng.
- b) Trạng thái cân bằng của mọi phản ứng thuận nghịch luôn có tốc độ phản ứng thuận (1) bằng tốc độ phản ứng nghịch, các phản ứng thuận và nghịch luôn diễn ra. Như vậy, cân bằng hóa học là (2) cân bằng động.
- c) Với một phản ứng hóa học, khi hằng số cân bằng rất lớn so với 1 thì ở trạng thái cân bằng, nồng độ các chất sản phẩm (1) lớn hơn nồng độ (2) các chất phản ứng.
Bài 1.2: Ghép đối tượng
- Cột A và B sẽ được ghép như sau:
- a - 4
- b - 1
- c - 2
- d - 3
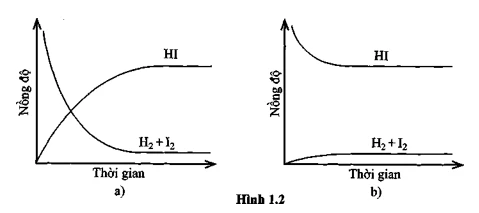
Bài 1.3: Quan sát đồ thị phản ứng
Chúng ta sẽ đánh giá các phát biểu từ đồ thị và xác định:
- A. Cả hai đồ thị đều mô tả phản ứng đã đạt đến trạng thái cân bằng.
- B. Cả hai đồ thị đều không mô tả phản ứng đã đạt đến trạng thái cân bằng.
- C. Chỉ đồ thị (a) mô tả phản ứng đã đạt đến trạng thái cân bằng.
- D. Chỉ đồ thị (b) mô tả phản ứng đã đạt đến trạng thái cân bằng.
Kết luận: Đáp án đúng là
A, cả hai đồ thị đều cho thấy phản ứng đã đạt đến trạng thái cân bằng.
Bài 1.4: Biểu thức hằng số cân bằng
Biểu thức hằng số cân bằng (Kc) của phản ứng C(s) + 2H2(g) ⇌ CH4(g) sẽ không bao gồm nồng độ của các chất rắn:
Kc = [CH4] / [H2]^2
Bài 1.5: Phân tích nồng độ
Với phản ứng A(g) ⇌ B(g) và Kc = 1,0 x 10^3, khi nồng độ của A = 1,0 x 10^-3 M, nồng độ B sẽ là:
Kc = [B] / [A] => [B] = Kc × [A] = 1,0 × 10^3 × 1,0 × 10^-3 = 1 M.
Bài 1.6: Nghiên cứu cân bằng
Tại các nhiệt độ khác nhau, cân bằng được xác định và khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ chất tham gia phản ứng.
Tác động của yếu tố môi trường đến cân bằng
Nhiệt độ và áp suất
- Nhiệt độ: Nếu phản ứng tận dụng nhiệt (tỏa nhiệt), việc tăng nhiệt sẽ làm cân bằng dịch theo chiều phản ứng nghịch. Ngược lại với phản ứng thu nhiệt.
- Áp suất: Tăng áp suất trong một phản ứng có số mol khí khác nhau sẽ làm cân bằng chuyển dịch sang chiều giảm số mol khí.
Phân tích sự ổn định hóa học trong cơ thể
Trong bài viết này, chúng ta cũng sẽ khám phá tầm quan trọng của sự cân bằng trong cơ thể con người, chẳng hạn như nồng độ glucose trong máu. Khi tiêu thụ thực phẩm, cơ thể sẽ sinh ra glucose thông qua quá trình tiêu hóa, và hormone insulin và glucagon sẽ giữ cho lượng glucose trong máu ổn định, thậm chí ở cả mức 0.1%.
Kết luận
Thông qua bài 1 SBT Hóa học 11, chúng ta không chỉ nắm vững kiến thức căn bản về cân bằng hóa học mà còn hiểu rõ hơn tác động của các yếu tố ngoại cảnh tới phản ứng hóa học. Đây là nền tảng vững chắc để hành trang của học sinh trên con đường tiếp cận sâu hơn với môn hóa học, chủ đề quan trọng trong giáo dục hiện đại.
Hy vọng bài viết này sẽ giúp ích cho việc học tập của các em, đồng thời khơi gợi niềm đam mê với môn hóa học và khám phá sâu hơn về các hiện tượng hóa học trong cuộc sống hàng ngày.