Cân bằng hóa học là một trong những khái niệm quan trọng trong lĩnh vực hóa học. Nó không chỉ giúp hiểu rõ hơn về các phản ứng hóa học mà còn có nhiều ứng dụng trong thực tế, như trong ngành công nghiệp hóa chất, môi trường và sức khỏe. Trong bài viết này, chúng ta sẽ đi sâu vào các yếu tố ảnh hưởng đến cân bằng hóa học, từ nhiệt độ đến áp suất, nồng độ và hơn thế nữa.

1. Khái Niệm Cân Bằng Hóa Học
Cân bằng hóa học xảy ra trong các phản ứng thuận nghịch, nơi mà các chất tham gia phản ứng có thể chuyển đổi lẫn nhau giữa dạng ban đầu và sản phẩm. Trạng thái cân bằng được định nghĩa là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Khi đạt đến trạng thái này, nồng độ của các chất không còn thay đổi nữa.
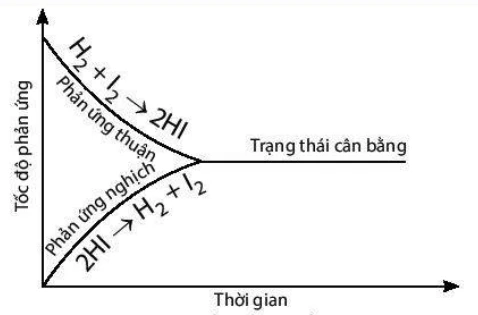
1.1 Phản Ứng Thuận Nghịch
Phản ứng thuận nghịch là loại phản ứng mà sản phẩm có thể trở lại thành các chất nguyên liệu. Ví dụ:
\[ \text{H}_2(g) + \text{I}_2(g) \rightleftharpoons 2\text{HI}(g) \]
Tại trạng thái cân bằng, nồng độ của \(H_2\), \(I_2\), và \(HI\) là không đổi. Điều này có nghĩa là mặc dù phản ứng vẫn diễn ra, nhưng không có sự thay đổi tổng thể nào trong nồng độ.

2. Các Yếu Tố Ảnh Hưởng Đến Cân Bằng Hóa Học

2.1 Nhiệt Độ
Nhiệt độ là một trong những yếu tố chủ yếu ảnh hưởng đến cán cân hóa học. Theo nguyên lý Le Chatelier, khi nhiệt độ của một phản ứng tỏa nhiệt (ΔH < 0) tăng lên, cân bằng sẽ chuyển dịch theo hướng giảm bớt nhiệt (chiều phản ứng nghịch). Ngược lại, nếu nhiệt độ giảm, cân bằng sẽ chuyển dịch theo chiều thuận để giải phóng nhiệt.
Thí dụ:
\[ 2 NO_2(g) \rightleftharpoons N_2O_4(g) \]
Khi tăng nhiệt độ, sản phẩm \(N_2O_4\) sẽ giảm đi, trong khi \(NO_2\) sẽ tăng.
2.2 Nồng Độ
Thay đổi nồng độ của các chất trong phản ứng cũng có ảnh hưởng đáng kể đến trạng thái cân bằng. Khi ta tăng nồng độ của một chất, cân bằng sẽ dịch chuyển về phía giảm nồng độ của chất đó, và ngược lại.
Ví dụ:
\[ CH_3COONa + H_2O \rightleftharpoons CH_3COOH + NaOH \]
Nếu ta thêm nhiều \(CH_3COONa\), cân bằng sẽ dịch chuyển sang phải, sản sinh thêm \(CH_3COOH\) và \(NaOH\).
2.3 Áp Suất
Áp suất ảnh hưởng đến phản ứng, đặc biệt là những phản ứng mà có sự thay đổi về số mol khí. Theo nguyên lý Le Chatelier, nếu áp suất được tăng lên, cân bằng sẽ dịch chuyển theo chiều giảm số mol khí.
Thí dụ:
\[ 2 NO_2(g) \rightleftharpoons N_2O_4(g) \]
Khi tăng áp suất, cân bằng sẽ dịch chuyển về phía \(N_2O_4\) (giảm số mol khí).
2.4 Chất Xúc Tác
Chất xúc tác không làm thay đổi vị trí cân bằng nhưng giúp cân bằng đạt trạng thái nhanh hơn. Nó tăng tốc độ của cả phản ứng thuận và nghịch với cùng một tỷ lệ, giúp hệ phản ứng nhanh chóng đạt được trạng thái cân bằng mà không ảnh hưởng đến tỷ lệ sản phẩm.
Ví dụ:
- Trong phản ứng tổng hợp amoniac:
\[ N_2(g) + 3H_2(g) \rightleftharpoons 2NH_3(g) \]
Chất xúc tác như Fe giúp phản ứng diễn ra nhanh hơn mà không làm thay đổi tỷ lệ \(K_c\).
2.5 Nguyên Lý Chuyển Dịch Cân Bằng Le Chatelier
Nguyên lý này nêu rõ rằng khi một hệ thống ở trạng thái cân bằng chịu tác động bên ngoài (như thay đổi nhiệt độ, nồng độ hay áp suất), cân bằng sẽ dịch chuyển theo chiều để giảm thiểu tác động đó. Điều này có ý nghĩa lớn trong công nghiệp, nơi có thể điều chỉnh các điều kiện để tối ưu hóa sản phẩm mong muốn.
Kết Luận
Cân bằng hóa học là một khía cạnh cơ bản trong ngành hóa học, có sự ảnh hưởng từ nhiều yếu tố khác nhau như nhiệt độ, nồng độ, áp suất và chất xúc tác. Hiểu rõ về chúng giúp ta điều chỉnh và tối ưu hóa các phản ứng hóa học, đồng thời ứng dụng trong thực tế, từ sản xuất công nghiệp đến nghiên cứu khoa học. Hy vọng rằng bài viết này đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc về các yếu tố ảnh hưởng đến cân bằng hóa học. Nếu bạn có bất kỳ câu hỏi hoặc thắc mắc nào, hãy để lại ý kiến dưới bài viết này!






















