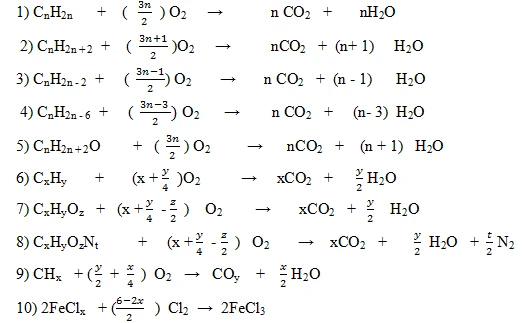PHƯƠNG TRÌNH HÓA HỌC LỚP 8: CÁC PHƯƠNG PHÁP LẬP VÀ CÂN BẰNG
Phương trình hóa học là một phần quan trọng trong chương trình học môn Hóa học lớp 8. Nó không chỉ giúp học sinh hiểu rõ về các phản ứng hóa học mà còn hỗ trợ trong việc áp dụng các kiến thức vào thực tế. Bài viết này sẽ đi sâu vào cách lập và cân bằng phương trình hóa học, giúp các bạn học sinh củng cố kiến thức một cách hiệu quả.
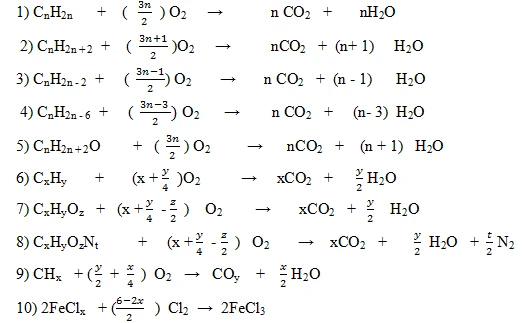
I. KHÁI NIỆM VỀ PHƯƠNG TRÌNH HÓA HỌC
Phương trình hóa học là một biểu thức thể hiện sự biến đổi của các chất trong một phản ứng hóa học. Nó bao gồm các chất tham gia phản ứng (reactants) và sản phẩm (products).
1. Cấu trúc của phương trình hóa học
Phương trình hóa học có thể được viết dưới dạng:
Biểu thức này cho biết rằng các chất phản ứng sẽ biến đổi thành các sản phẩm dưới một số điều kiện nhất định.
2. Ý nghĩa của phương trình hóa học
Phương trình hóa học không chỉ phản ánh sự biến đổi của chất mà còn cung cấp thông tin về lượng chất tham gia và sản phẩm. Từ đó, học sinh có thể hiểu rõ hơn về tính toán khối lượng, số mol và các biến đổi hóa học khác.
II. CÁC BƯỚC LẬP PHƯƠNG TRÌNH HÓA HỌC
Để lập phương trình hóa học một cách chính xác, các em cần làm theo các bước sau:
Bước 1: Viết sơ đồ phản ứng
Đầu tiên, hãy xác định các chất tham gia và sản phẩm của phản ứng. Viết chúng dưới dạng công thức hóa học.
Bước 2: Đặt hệ số cho các chất
Sử dụng phương pháp cân bằng để đảm bảo số nguyên tử cho mỗi nguyên tố ở hai bên của phương trình là bằng nhau. Dưới đây là một số cách giúp các em thực hiện điều này.
Bước 3: Hoàn thành phương trình
Cuối cùng, sau khi đã cân bằng số nguyên tử, hãy hoàn thành phương trình và kiểm tra lại một lần nữa.
III. CÁC PHƯƠNG PHÁP CÂN BẰNG PHƯƠNG TRÌNH HÓA HỌC
1. Phương pháp “Chẵn - Lẻ”
Đây là phương pháp khá phổ biến, giúp cân bằng các phản ứng có hệ số lẻ một cách dễ dàng.
Ví dụ 1: Cân bằng phản ứng:
\[ \text{Al} + \text{HCl} → \text{AlCl}_3 + \text{H}_2 \]
Giải:
- Bước 1: Thêm hệ số 2 vào trước \( \text{AlCl}_3 \):
\[ \text{Al} + \text{HCl} → 2\text{AlCl}_3 + \text{H}_2 \]
- Bước 2: Cân bằng nguyên tử Cl:
Thêm hệ số 6 trước HCl:
\[ \text{Al} + 6\text{HCl} → 2\text{AlCl}_3 + \text{H}_2 \]
- Bước 3: Tiếp theo cân bằng nguyên tử Al và H:
\[ 2\text{Al} + 6\text{HCl} → 2\text{AlCl}_3 + 3\text{H}_2 \]
2. Phương pháp “Đại số”
Phương pháp này thường được sử dụng cho các phương trình phức tạp hơn, áp dụng cho học sinh có nền tảng vững chắc.
Ví dụ: Cân bằng phản ứng:
\[ \text{Cu} + \text{H}_2\text{SO}_4 → \text{CuSO}_4 + \text{SO}_2 + \text{H}_2\text{O} \]
Giải:
- Bước 1: Đặt các hệ số a, b, c, d, e tại các chất:
\[ a\text{Cu} + b\text{H}_2\text{SO}_4 → c\text{CuSO}_4 + d\text{SO}_2 + e\text{H}_2\text{O} \]
- Bước 2: Thiết lập hệ phương trình dựa vào số nguyên tử của từng nguyên tố:
- Cu: \( a = c \)
- S: \( b = c + d \)
- H: \( 2b = 2e \)
- O: \( 4b = 4c + 2d + e \)
- Bước 3: Giải hệ phương trình và tìm các hệ số.
IV. BÀI TẬP VẬN DỤNG
Để thực hành tốt hơn kỹ năng lập và cân bằng phương trình hóa học, hãy cùng giải một số bài tập cụ thể.
Bài 1: Cân bằng các phương trình hóa học sau
1) MgCl₂ + KOH → Mg(OH)₂ + KCl
2) Cu(OH)₂ + HCl → CuCl₂ + H₂O
3) FeO + HCl → FeCl₂ + H₂O
Bài 2: Lập phương trình hóa học cho các phản ứng sau và cho biết tỷ lệ số nguyên tử, phân tử
a) Na + O₂ → Na₂O
b) P₂O₅ + H₂O → H₃PO₄
Bài 3: Phân tích các phương trình phức tạp hơn và lập phương trình cho từng phản ứng.
a) NH₃ + O₂ → NO + H₂O
b) S + HNO₃ → H₂SO₄ + NO
V. KẾT LUẬN
Cân bằng phương trình hóa học là một kỹ năng nền tảng quan trọng mà học sinh cần nắm vững trong chương trình Hóa học lớp 8. Bằng việc áp dụng các phương pháp như "chẵn-lẻ" và "đại số", học sinh có thể giải quyết được những bài toán phức tạp và hiểu sâu hơn về các phản ứng hóa học. Các bài tập và ví dụ cụ thể sẽ giúp củng cố kỹ năng và tự tin hơn khi đối diện với các bài tập trong sách. Hãy luyện tập thường xuyên để thành thạo kỹ năng này!