Giải hóa 10: Hiểu và áp dụng hóa trị và số oxi hóa
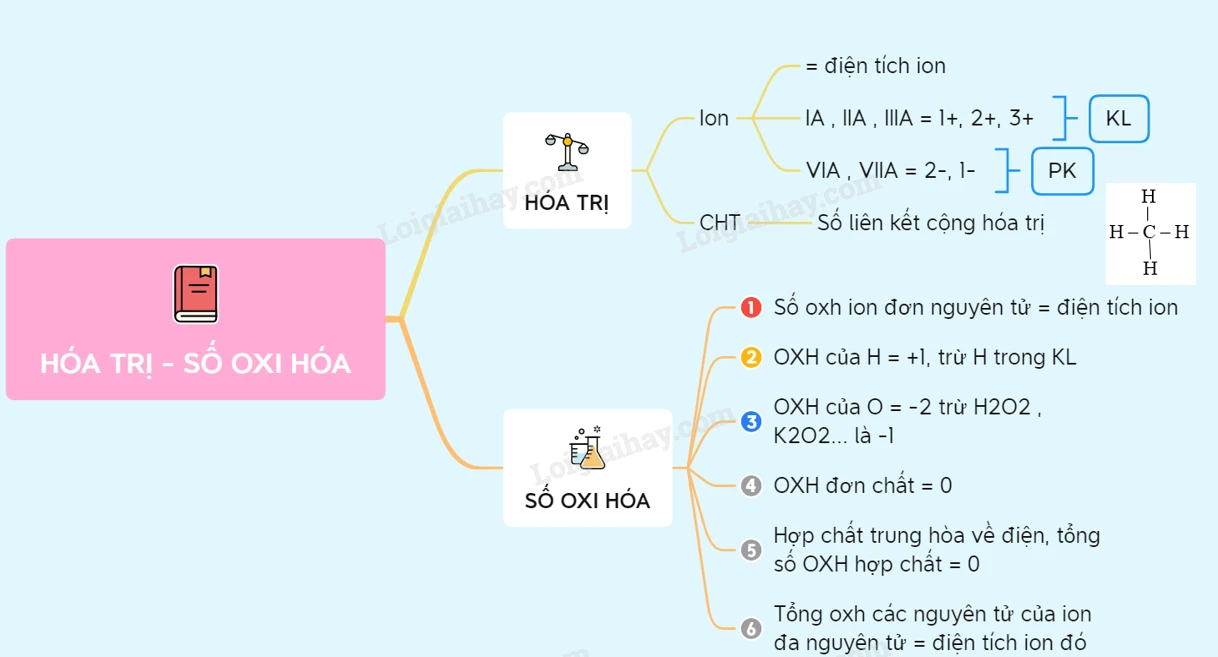
I. Hóa trị
1. Hóa trị trong hợp chất ion
Trong hóa học, hóa trị là một đại lượng quan trọng giúp chúng ta hiểu cách thức các nguyên tố tương tác và liên kết với nhau. Trong hợp chất ion, hóa trị được xác định bởi điện tích của ion. Cụ thể, điện tích đó phản ánh khả năng nhường hoặc nhận electron của nguyên tử trong một phản ứng hóa học.
Ví dụ điển hình
Trong hợp chất NaCl, Na có điện hóa trị là 1+ (điện tích dương), trong khi Cl có điện hóa trị là 1- (điện tích âm). Điều này cho thấy Na sẽ nhường một electron cho Cl, tạo thành cation Na+ và anion Cl-.
Quy ước ghi chép
Khi thể hiện điện hóa trị, chúng ta cần ghi giá trị điện tích trước, và dấu của điện tích sau. Quy tắc này giúp rõ ràng hơn trong việc xác định hóa trị của các nguyên tố.
- Các nguyên tố kim loại thuộc nhóm IA, IIA, IIIA có khả năng nhường từ 1 đến 3 electron do số electron trên lớp ngoài cùng của chúng là 1, 2, 3. Do đó, hóa trị của chúng lần lượt là 1+, 2+, 3+.
- Ngược lại, các nguyên tố phi kim thuộc nhóm VIA và VIIA có 6 hoặc 7 electron ở lớp ngoài cùng, cho phép chúng nhận thêm 2 hoặc 1 electron. Vì vậy, hóa trị của các nguyên tố này là 2- hoặc 1-.
2. Hóa trị trong hợp chất cộng hóa trị
Trong hợp chất cộng hóa trị, hóa trị được xác định bằng số liên kết cộng hóa trị mà một nguyên tố tạo ra trong phân tử. Số cộng hóa trị này chính là hóa trị của nguyên tố đó.
Ví dụ cụ thể
- Trong phân tử nước (H2O), nguyên tố H có cộng hóa trị là 1 và nguyên tố O có cộng hóa trị là 2.
- Trong phân tử metan (CH4), nguyên tố C có cộng hóa trị là 4, trong khi nguyên tố H lại có cộng hóa trị là 1.
II. Số oxi hóa
Số oxi hóa là một khái niệm quan trọng trong hóa học, được định nghĩa như sau:
- Số oxi hóa của một nguyên tố trong hợp chất là điện tích tưởng tượng của nguyên tử nguyên tố đó, giả định rằng liên kết giữa các nguyên tử là liên kết ion.
Để xác định số oxi hóa, chúng ta áp dụng các quy tắc sau:
Quy tắc xác định số oxi hóa
- Số oxi hóa của ion đơn nguyên tử: Bằng điện tích của ion đó.
- Ví dụ: Ion Ca²⁺ có điện tích dương 2, nên số oxi hóa là +2.
- Ngược lại, ion Cl⁻ có điện tích âm 1, số oxi hóa là -1.
- Số oxi hóa của hiđro: Trong hợp chất, hiđro thường có số oxi hóa là +1, ngoại trừ trong hiđrua kim loại, khi đó số oxi hóa của hiđro là -1.
- Số oxi hóa của oxi: Trong hầu hết các hợp chất, số oxi hóa của oxi là -2, nhưng có một số ngoại lệ như trong H2O2 hoặc K2O2, khi số oxi hóa của oxi là -1.
- Đơn chất: Số oxi hóa của các nguyên tố trong trạng thái đơn chất luôn bằng 0.
- Ví dụ: Fe, Cl2.
- Tính trung hòa: Tổng số oxi hóa trong một hợp chất trung hòa về điện phải bằng 0.
- Ion đa nguyên tử: Tổng số oxi hóa của tất cả các nguyên tử trong ion đa nguyên tử phải bằng điện tích của ion đó.
III. Ứng dụng thực tế của hóa trị và số oxi hóa
Hóa trị và số oxi hóa không chỉ giúp chúng ta hiểu cách mà các nguyên tố tương tác trong phản ứng hóa học, mà còn là cơ sở quan trọng trong việc dự đoán các tính chất và hành vi của hợp chất hóa học.
1. Dự đoán tính chất của hợp chất
Biết được hóa trị và số oxi hóa giúp chúng ta dự đoán tính chất của hợp chất, ví dụ như độ bền, độ hòa tan, và khả năng phản ứng với các chất khác. Hợp chất với hóa trị cao có thể cho thấy độ oxi hóa cao và thường sẽ phản ứng mạnh mẽ hơn.
2. Ứng dụng trong hóa học hữu cơ
Trong hóa học hữu cơ, việc xác định hóa trị và số oxi hóa là điều cần thiết để hiểu cấu trúc của các hợp chất hữu cơ. Ví dụ, việc kết nối các nguyên tử carbon, hydro, oxy, và các nguyên tố khác trong phân tử hữu cơ thường dựa vào hóa trị của từng nguyên tố.
3. Tính toán lượng chất trong phản ứng
Sử dụng hóa trị và số oxi hóa cũng giúp trong việc tính toán các phản ứng hóa học để xác định lượng chất tham gia và sản phẩm tạo thành. Điều này rất quan trọng trong các lĩnh vực như hóa học phân tích, ngành công nghiệp hóa chất, và dược phẩm.
IV. Kết luận
Hóa trị và số oxi hóa là những khái niệm cốt lõi trong hóa học, không chỉ đặt nền móng cho sự hiểu biết về các liên kết giữa các nguyên tố mà còn ứng dụng rộng rãi trong nghiên cứu và thực tiễn. Nắm vững được hai khái niệm này sẽ mang lại lợi ích lớn cho các học sinh, sinh viên trong việc thực hiện các bài tập, thí nghiệm, và nghiên cứu hóa học.
Việc học và hiểu hóa trị cũng như số oxi hóa sẽ giúp bạn không chỉ trong các bài kiểm tra mà còn trong việc khám phá thế giới hóa học xung quanh. Mong rằng qua bài viết này, bạn đã có cái nhìn sâu sắc hơn về hai khái niệm này và làm thế nào để áp dụng chúng trong thực tế. Hãy tiếp tục tìm hiểu và thực hành, vì hóa học luôn có điều thú vị đang chờ đón bạn!