Xung quanh chúng ta, kim loại là một phần không thể thiếu trong cuộc sống hàng ngày. Từ các công trình xây dựng cho đến các thiết bị điện tử, kim loại đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau. Đặc biệt, tính chất hóa học đặc trưng của kim loại là yếu tố quyết định đến tính ứng dụng của chúng trong cuộc sống. Bài viết này sẽ cung cấp cho bạn những thông tin chi tiết và hữu ích về các tính chất hóa học của kim loại, giúp bạn hiểu rõ hơn về vật liệu này.

1. Các Tính Chất Hóa Học Đặc Trưng Của Kim Loại Hiện Nay
1.1. Kim Loại Tác Dụng Với Oxi
Một trong những tính chất hóa học đầu tiên của kim loại là khả năng phản ứng với oxi. Hầu hết các kim loại đều có thể tác dụng với oxi ở nhiệt độ thường hoặc cao, tạo ra các hợp chất oxit. Điều này có thể thấy rõ trong phản ứng của sắt với oxi, dẫn đến sự hình thành gỉ sét.
Ví dụ:
\[ 3Fe + 2O_2 \rightarrow Fe_3O_4 \]
Tuy nhiên, không phải tất cả các kim loại đều phản ứng với oxi. Những kim loại quý như vàng (Au), bạc (Ag) và bạch kim (Pt) rất khó phản ứng với oxi trong điều kiện bình thường, điều này khiến chúng trở nên quý giá trong công nghiệp và trang sức.

1.2. Kim Loại Tác Dụng Với Axit
Khi kim loại tiếp xúc với axit, thường sẽ xảy ra phản ứng hóa học sinh ra khí hidro và muối. Phản ứng này không chỉ giúp chúng ta nhận biết tính chất của kim loại mà còn có ứng dụng trong nhiều lĩnh vực.
Ví dụ:
\[ Fe + 2HCl \rightarrow FeCl_2 + H_2 \]
Phản ứng giữa sắt và axit clohidric là một ví dụ điển hình về việc kim loại có thể tương tác mạnh mẽ với axit, phản ứng sinh ra khí hidro.
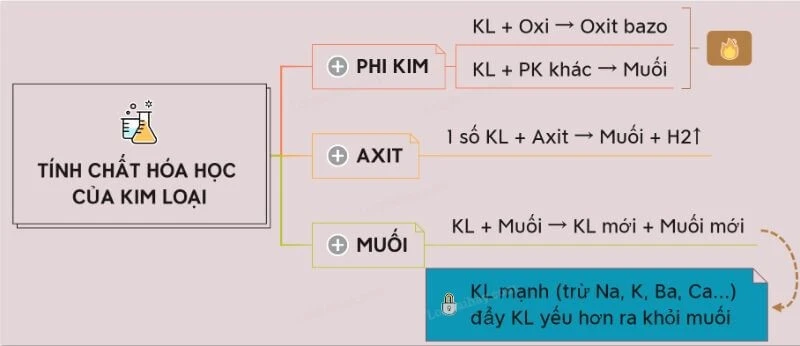
1.3. Kim Loại Tác Dụng Với Phi Kim
Kim loại cũng có khả năng phản ứng với các nguyên tố phi kim. Các phi kim thường nằm ở bên phải bảng tuần hoàn và không có tính dẫn điện. Kim loại có thể nhường electron cho các phi kim, tạo ra các hợp chất mới.
Ví dụ:
\[ Cu + S \rightarrow CuS \]
Trong phản ứng này, đồng (Cu) tác dụng với lưu huỳnh (S) để tạo ra đồng sulfide.
1.4. Kim Loại Tác Dụng Với Nước
Phản ứng của kim loại với nước là một đặc trưng quan trọng. Nhiều kim loại có thể phản ứng với nước ở nhiệt độ cao hoặc nhiệt độ thường tạo ra bazơ, khí hiđro và oxit.
Ví dụ:
\[ 2Na + 2H_2O \rightarrow 2NaOH + H_2 \]
Phản ứng giữa natri và nước cho thấy sự tương tác mạnh mẽ của kim loại với nước, sinh ra dung dịch bazơ natri hydroxide và khí hiđro.
1.5. Kim Loại Tác Dụng Với Muối
Khi kim loại kết hợp với muối của kim loại khác, có thể tạo ra muối mới và kim loại khác. Phản ứng này thường xảy ra trong các quá trình hóa học và là cơ sở cho việc tạo ra các hợp kim.
Ví dụ:
\[ Fe + CuSO_4 \rightarrow Cu + FeSO_4 \]
Phản ứng này cho thấy sắt (Fe) có thể thay thế đồng (Cu) trong muối đồng sulfate, tạo ra đồng và muối sắt sulfate.
2. Cấu Tạo Và Phân Nhóm Kim Loại
2.1. Cấu Tạo Nguyên Tử
Cấu tạo nguyên tử của kim loại có những đặc điểm riêng biệt. Nguyên tử của hầu hết các nguyên tố kim loại đều có ít electron ở lớp ngoài cùng (1e, 2e hoặc 3e).
Ví dụ:
- Natri (Na): [Ne] 3s¹
- Magie (Mg): [Ne] 3s²
- Nhôm (Al): [Ne] 3s² 3p¹
Trong cùng một chu kì, nguyên tử kim loại có bán kính lớn hơn và điện tích hạt nhân nhỏ hơn so với nguyên tố phi kim, điều này làm cho kim loại dễ dàng nhường electron hơn.
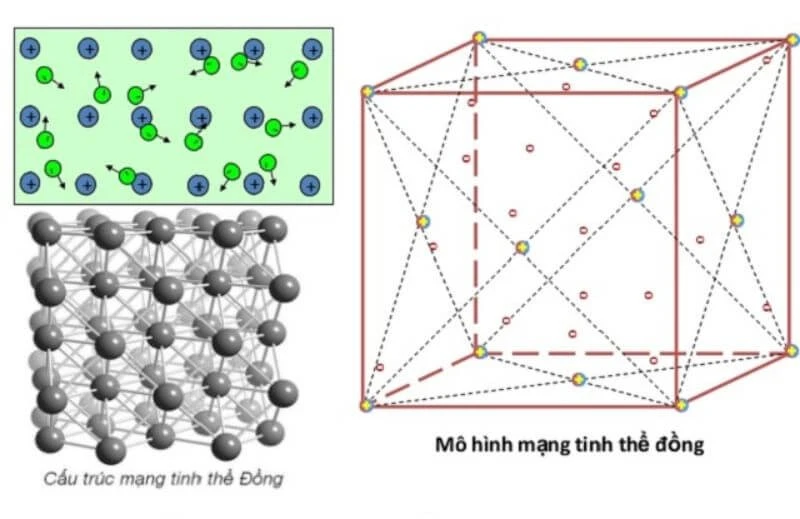
2.2. Cấu Tạo Tinh Thể
Tại nhiệt độ thường, hầu hết các kim loại tồn tại ở thể rắn với cấu tạo tinh thể. Các nguyên tử và ion kim loại nằm ở những nút của mạng tinh thể, tạo thành cấu trúc vững chắc.
- Mạng Tinh Thể Lục Phương: Là kiểu mạng tinh thể có nhiều kim loại quý như magiê.
- Mạng Tinh Thể Lập Phương Tâm Diện: Thường gặp ở các kim loại như vàng và bạc.
- Mạng Tinh Thể Lập Phương Tâm Khối: Có trong nhiều kim loại phổ biến như sắt.
2.3. Phân Nhóm Kim Loại
Kim loại có thể được phân chia thành nhiều nhóm khác nhau dựa trên tính chất và ứng dụng:
- Kim Loại Cơ Bản: Gồm những kim loại dễ phản ứng với môi trường xung quanh, dễ bị oxy hóa và ăn mòn, như sắt (Fe), kẽm (Zn).
- Kim Loại Hiếm: Bao gồm vàng (Au), bạc (Ag) và bạch kim, ít bị ăn mòn và có giá trị kinh tế cao.
- Kim Loại Đen: Là các kim loại có từ tính và chứa sắt, như thép và gang. Chúng có độ bền cao nhưng dễ bị rỉ sét.
- Kim Loại Màu: Không chứa sắt nhưng có đặc điểm riêng biệt, thường được sử dụng trong sản xuất và chế tạo, ví dụ như đồng (Cu) và nhôm (Al).
3. Vai Trò Của Kim Loại Trong Đời Sống Con Người
Kim loại không chỉ là một phần trong tự nhiên mà còn có vai trò quan trọng trong mọi lĩnh vực của cuộc sống. Trong ngành xây dựng, kim loại được sử dụng để tạo ra các công trình lớn, từ cầu đường đến nhà cửa. Trong công nghiệp chế tạo, kim loại là nguyên liệu chính để sản xuất máy móc, thiết bị.
3.1. Ứng Dụng Trong Công Nghiệp
- Ngành Xây Dựng: Kim loại như thép và nhôm được sử dụng để xây dựng các công trình lớn nhờ vào độ bền và tính linh hoạt của chúng.
- Ngành Điện Tử: Kim loại như đồng được sử dụng để chế tạo dây dẫn điện, nhờ vào khả năng dẫn điện tốt.
3.2. Ứng Dụng Trong Y Tế
Nhiều kim loại cũng được ứng dụng trong y tế, ví dụ như bạc thường được sử dụng trong các dụng cụ y tế vì tính kháng khuẩn của nó.
3.3. Ứng Dụng Trong Công Nghệ Thông Tin
Kim loại được sử dụng trong sản xuất các linh kiện điện tử, từ điện thoại di động đến máy tính, nhờ vào tính chất dẫn điện và độ bền cao.
Kết Luận
Qua bài viết này, bạn đã nắm được các tính chất hóa học đặc trưng của kim loại, từ khả năng phản ứng với oxi, axit, nước cho đến cấu tạo và vai trò của chúng trong đời sống. Kim loại không chỉ là vật liệu cần thiết trong xây dựng và chế tạo, mà còn có vai trò quan trọng trong nhiều lĩnh vực khác nhau. Hy vọng rằng những thông tin trên sẽ hữu ích cho bạn trong việc hiểu rõ hơn về kim loại và ứng dụng của chúng trong cuộc sống hàng ngày.